某些金属与非金属的化合物的成分随合成气氛的不同而变化,并不一定严格遵守化学式中的计量配比。这种非化学计量化合物是陶瓷材料半导体化的原料。掌握这些非化学计量化合物的性质和缺陷化学反应式对研究离子导体的导电性有重要的意义。
作为基础知识,首先要了解晶体中的本征缺陷浓度及其生成能的关系。从缺陷的形成途径来分,有热缺陷和掺杂缺陷(即固溶缺陷)两类。前者是由于热涨落导致的,与材料自身的性能和结构有关,所以又称“本征缺陷”。
热缺陷主要包括弗兰克尔缺陷和肖特基缺陷。弗兰克尔缺陷是在晶体中形成等量的空位和间隙原子,对金属晶体,就是形成等量的金属离子空位和间隙中的金属离子;对离子晶体,由于前述的正负离子半径大小不同的原因,只形成等量的正离子间隙和正离子空位。以离子晶体MX为例,形成的弗兰克尔缺陷就是VM和Mi。用[VM]和[Mi]分别表示它们的浓度,则根据热缺陷的波尔兹曼分布,有如下的式子成立:
3-3-1
式中k为波尔兹曼常数,R为常数,E为生成一个正离子间隙和一个正离子空位所需要的能量,Em为生成一摩尔正离子间隙和一摩尔正离子空位所需要的能量,简称缺陷的生成能。在无外界干扰的情况下,因间隙和空位是等量的,有:
3-3-2
肖脱基缺陷是空位缺陷。对金属,就是形成金属离子空位;对离子晶体,就是形成等量的正离子和负离子空位,即Vm和Vx。缺陷浓度与其生成能的关系有类似于式3-3-1和3-3-2的表达式。以MgO为例:
,
下面介绍几种不同类型的非化学计量化合物,并研究它们离子电导与氧分压的关系。
a.非化学计量化合物主要类型
1.阴离子空位型
这种类型以ZrO2,TiO2,KCl,NaCl,KBr为代表,其特点是在还原气氛下易失氧而产生弱束缚电子。如TiO2在还原气氛中容易形成氧离子空位,并使正四价的钛离子降为正三价,具体过程可以用如下的一系列缺陷反应方程式来表示:
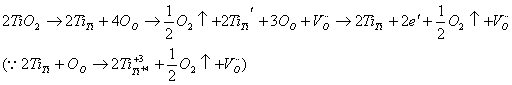
实质为:
3-3-3
由于吸附在Ti上的电子的非局域性,这种非化学计量的TiO2有一定的电子导电性,是N型半导体材料(氧离子迁移速率远小于电子迁移速率,故氧化钛是一电子导电为主)。这种非局域性的电子也叫“弱束缚电子”。
式3-3-3的反应达平衡时,由物理化学知识,可以得到平衡常数K与反应物、生成物浓度的关系:
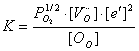
考虑到体系中失去的氧很少,认为;从反应式中可得,则3-3-4
平衡常数K与反应吉布斯自由能变的关系为:
即对一定的反应,K是温度的函数。则温度一定的情况下,由式3-3-4有:
由于TiO2是电子导电,其电导率,所以。
从以上的推导中,我们得到了TiO2电导率与氧分压的关系,其它的缺阴离子型非化学计量化合物也有类似的关系成立。利用这种关系,可以制作氧分压传感器、氧离子导体和燃料电池。ZrO2与TiO2不同之处在于:ZrO2氧离子空位扩散速度快,氧离子通过空位的扩散是电导的主要因素。图3-6为ZrO2氧分压传感器示意图。
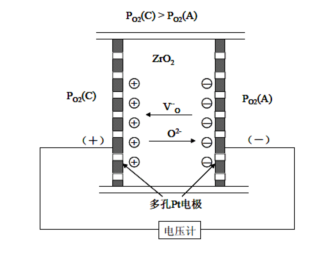
图3-6氧分压传感器的示意图
氧离子O2-从高氧分压侧PO2(C)低氧分压侧PO2(A)移动,结果在高氧分压侧产生电荷积累,在低氧分压侧产生负电荷积累,即
在阳极侧:
在阴极侧:
按照能斯脱理论,产生的电动势为:
式中,R为气体常数,F为法拉第常数,T是热力学温度。当一侧的氧分压已知的条件下,可以检测另一侧的氧分压的大小。ZrO2氧敏元件广泛应用于汽车锅炉燃烧空然比的控制、冶炼金属中氧浓度以及氧化物热力学数据的测量等。若从外部施加电压,还可以用作控制氧浓度的化学泵。
可以把ZrO2看作氧离子导体,当其两侧的氧分压不同时,在ZrO2内部会产生由高氧分压到低氧分压的氧离子流。用这种性质制作的氧分压传感器可以用来测燃烧过程中的还原—氧化比。
CO和CO2的分压比可以看作燃烧过程的还原—氧化比,其反应式为:,平衡常数
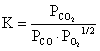
,则还原—氧化比为:。查得此反应的平衡常数,再用氧分压传感器测氧分压,代入上式,即可得出还原—氧化比。
若将某一侧的氧气换成氢气或一氧化碳,控制该侧的氧分压,则在两侧形成固定的电势差,可制成无汞无污染的“燃料电池”,有很好的前景。
2.阳离子间隙型
以ZnO和CdO为代表,它们都是阳离子处在晶格间隙的类型,并由此产生弱束缚电子,是N型半导体材料。
将ZnO放入Zn蒸汽中加热,Zn会进入ZnO的晶格间隙,缺陷反应方程式为:
3-3-5
或3-3-6
一般以式3-3-5为主,因为Zn完全电离为Zni..比较困难。式3-3-5对应的反应平衡常数为:
从而得到的ZnO电导率为:
对于阳离子间隙型化合物,其缺陷反应的实质就是:
3-3-7
3.阴离子间隙型
以UO2为代表,其缺陷反应实质为:
3-3-8
可见阴离子间隙型化合物的导电机制是电子空穴导电,所以是p型半导体材料。同样,用平衡常数表达式可以推出其电导率为:
4.阳离子空位型
以FeO为例,FeO中总有正二价的亚铁离子变成正三价的铁离子,并产生二价铁离子空位。一般也称FeO为“非化学整比化合物”,其缺陷反应方程式如下:
实质是:3-3-9
而且
![]()
由平衡常数表达式推出的电导率为:
FeO电导率和氧分压之间的关系可用图3-7表示。
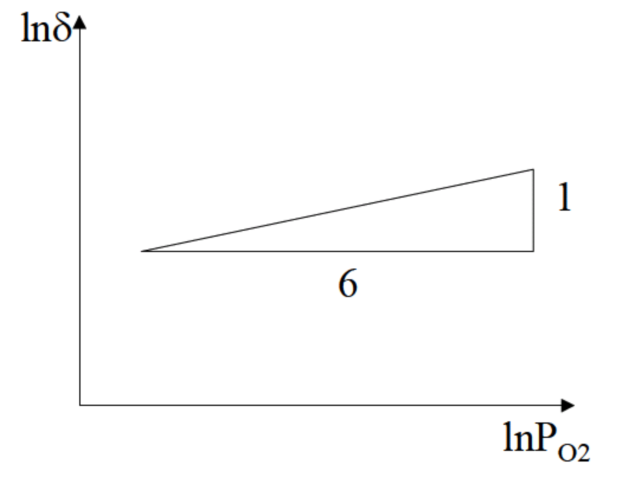
图3-7FeO电导率和氧分压之间的关系
以上给出了四种常见的非化学计量化合物的缺陷反应式,它们的导电机制和电导率与氧分压的关系。为方便查询,将这四种的代表化合物的化学式列出:
Ⅰ型(缺阴离子型):
Ⅱ型(阳离子间隙型):
Ⅲ型(阴离子间隙型):UO2+x
Ⅳ型(缺阳离子型):
可以看出:首先,对某种化合物来说,分类并不是固定的。如TiO2,在不同的氧分压下其导电机制是不同的。低氧分压下是电子导电,高氧分压下是空穴导电;其次,由于以上的非化学计量化合物的电导率都与氧分压的次方成比例,故可以做ln(deta)~lnPO2图,从斜率就可判断该化合物的导电机制。
ZnO这种材料容易受激,产生弱束缚的电子和空穴。若将ZnO放在H2S水溶液中,并用紫外光照射激发,则产生的弱束缚电子和空穴会与H2S反应:
从而除去硫化氢。由于石油裂解过程是在氢气气氛下进行,石油中的硫会形成硫化氢。所以ZnO可用于石油的脱硫。
b.化学式
化学式的写法要遵守电中性原则。一般考虑1mol基体对应xmol置换离子。举例如下:
1)向1mol的ZrO2中掺入xmol CaO发生置换反应,方程式为:
则ZrO2的化学式为:Zr1-xCaxO2-x它表示xmol CaO提供xmol的钙离子,置换了xmol的锆离子,并由于置换离子的价数不同,在基体中造成了xmol氧空位。用电中性原则检验有:。
2)向1mol的ZrO2中掺入CaO发生反应:
即一部分钙离子置换了锆离子,另一部分钙离子填在氧化锆晶格的间隙中形成间隙离子。仍以置换离子数为xmol,则共有2xmol钙离子反应,ZrO2的化学式为:Zr1-xCa2xO2。
3)向1mol的Al2O3中掺入xmol MgO发生置换反应,方程式为:
按前述原则,Al2O3的化学式为:Al2-xMgxO3-0.5x。
4)向1mol的Al2O3中掺入xmol MgO发生填隙反应:
按上述原则,Al2O3的化学式为:Al2-0.667xMgxO3。
5)向1mol的Al2O3中掺入Cr2O3发生置换反应:
此为等价置换,认为掺杂的铬离子为xmol,则Al2O3的化学式为Al2-xCrxO3。
6)1mol的5)中形成的Al2-xCrxO3中再掺入xmol NiO,发生置换反应:
。则Al2O3的化学式为Al2-x-yCrxNiyO3-0.5y。用电中性条件检验:3(2-x-y)+3x+2y-2(3-0.5x)=0。





